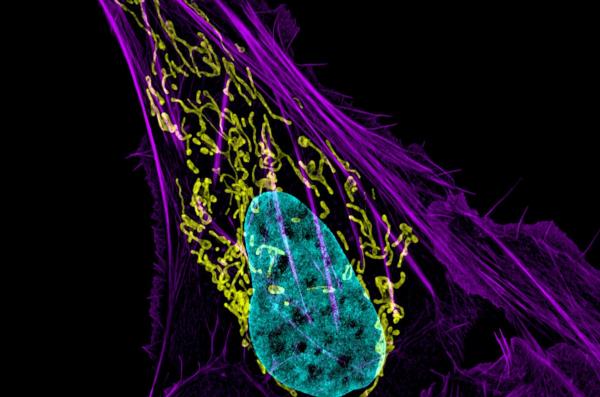
科学家们正在用激光照射癌细胞的能量中心,试图破坏这些能量来源,导致癌细胞大面积死亡。
在最近的一项研究中,研究人员使用专门针对癌细胞制造的纳米颗粒来进行能量破坏基因治疗。实验表明,靶向治疗可有效减少小鼠侵袭性乳腺癌肿瘤和胶质母细胞瘤脑肿瘤。
利用一种在细胞内产生光激活电流的方法,研究小组克服了分解这些细胞能量中心(即线粒体)内部结构的主要障碍。这项技术被称为mLumiOpto。
共同主要作者X. Margaret Liu是俄亥俄州立大学化学和生物分子工程教授,她与Zhou一起进行了这项研究。刘创造了用于将基因疗法精确地传递给癌细胞的颗粒。刘和周都是俄亥俄州立大学综合癌症中心的研究人员。
这项研究发表在《癌症研究》杂志上。
由于线粒体是为细胞提供能量的主要来源,因此它们一直被视为抗癌治疗的理想目标;然而,这些尝试受到它们不透水的内膜的阻碍。
五年前,周的实验室通过找出如何利用内膜的弱点来破解密码,内膜的弱点是一种电荷差异,它维持了膜的结构,并使其按预期工作。
Zhou补充说:“以前的尝试是使用一种药物试剂来对抗癌细胞中线粒体的特定活性途径。我们的方法直接针对线粒体,利用外部基因激活一个杀死细胞的过程。这是一个优势,我们已经证明,我们可以在杀死不同类型的癌细胞方面取得非常好的结果。”
周之前的细胞研究表明,一种产生电流的蛋白质可以破坏线粒体的内膜。研究人员使用激光来激活光诱导的蛋白质。该团队在这个新项目中创建的内部光源对于将该技术转化为临床应用至关重要。
这种方法需要传递两种不同分子的遗传信息:一种是能发出生物发光的酶,另一种是能产生正电荷电流的光敏蛋白CoChR。
当基因在线粒体中表达时产生的蛋白质,在经过修饰的病毒颗粒中被运送到癌细胞中。随后注射一种特定的化学物质,通过打开酶的光来激活CoChR,从而导致线粒体崩溃。
确保这种治疗不影响健康细胞是战斗的另一半。
刘的实验室专注于开发靶向抗癌疗法。具有良好特征的腺相关病毒(AAV)是一种传染性最低的病毒,旨在携带基因并促进其表达以达到治疗目的,是本研究中使用的递送机制的基础。
通过加入一个启动子蛋白来增加癌细胞中CoChR和生物发光酶的产生,科学家们提高了该系统的癌症特异性。此外,研究人员利用人类细胞制造了AAV,它将基因包装的病毒包含在一种天然存在的纳米载体中,这种载体类似于生物体液和人类血液中的细胞外囊泡。
最后,研究人员创造了一种单克隆抗体,旨在找到癌细胞表面的受体,并将其连接到递送颗粒上。
刘补充说:“这种单克隆抗体可以识别一种特定的受体,因此它可以发现癌细胞并传递我们的治疗基因。我们使用了多种工具来证实这一效果。在构建了具有癌症特异性启动子和癌症靶向纳米颗粒的aav后,我们发现这种疗法对治疗多种癌症非常有效。”
在小鼠模型上进行的实验显示,与未经治疗的小鼠相比,基因治疗方法显著降低了两种快速扩散、难以治疗的癌症的肿瘤负担:三阴性乳腺癌和胶质母细胞瘤脑癌。这种治疗提高了胶质母细胞瘤小鼠的存活率,并缩小了肿瘤的大小。
使用动物成像的研究也表明,基因治疗的效果只在癌细胞中可见,而在健康组织中不可见。结果还表明,在肿瘤微环境中触发针对癌细胞的免疫反应是附着单克隆抗体的另一个优势。
该小组正在研究mLumiOpto对三阴性乳腺癌、胶质母细胞瘤和其他癌症的进一步治疗效果。俄亥俄州立大学已经为这些技术提交了临时专利申请。
为您推荐:
- 教程辅助“多乐麻将外卦神器下载安装!详细开挂教程已更新-知乎 2025-06-06
- 由于收银机故障,麦当劳在日本关闭了30%的门店 2025-06-06
- 玩家实测“麻友圈2贵阳捉鸡麻将开挂神器(详细真的有挂)-知乎 2025-06-06
- 必看教程“途游麻将开挂器下载手机版”其实确实有挂_科技快讯_喜临门 2025-06-06
- 教程辅助“微乐湖南麻将怎样免费开挂”其实确实有挂 2025-06-06
- 恩比德摆脱赛前的颓势,带领76人以118-114战胜凯尔特人 2025-06-06

